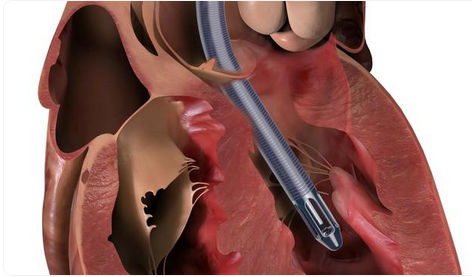
3月30日,美国食品和药物管理局(FDA)发出最高级别警报,召回一款心脏泵,原因是存在安全风险。此次召回涉及美国境内超过66000台设备。

这款心脏泵主要用于医疗过程中或严重心脏病发作后对心室中的血液泵送提供短期支持。然而,FDA指出,该心脏泵的泵导管可能在手术过程中刺穿心脏左心室壁,导致严重后果,包括左心室穿孔、游离壁破裂、高血压、供血不足以及死亡。据报道,相关事件已导致49人死亡、129人重伤。
这款被召回的Impella心脏泵由美国阿比奥梅德(Abiomed)公司生产,投入使用时间为2021年10月10日至2023年10月10日。
据了解,此次全球范围内召回的Impella心脏泵共涉及6个型号,包括Impella 2.5、Impella 5.0、Impella LD、带SmartAssist功能的Impella 5.5、Impella CP以及带SmartAssist功能的Impella CP。而被誉为“世界上最小的人工心脏”的Impella ECP(直径仅有3mm)并未受到召回。
召回范围涉及多个国家,包括美国、日本、澳大利亚、加拿大、德国、法国、印度、墨西哥等,还包括中国台湾地区。在此次召回中,美国境内66390件产品被召回,而在美国境外超过2.6万件产品也受到召回。
此外,去年曾发生过3次I级召回事件。
今年的召回规模创下了历史新高。原本设计用于在高风险手术期间或严重心脏病发作后为患者提供临时心脏支持的Impella心脏泵,却因使用不当可能导致严重健康问题,甚至死亡。根据FDA的警告,该设备的导管可能刺穿心脏,引发高血压、血流不足等问题。
回顾过去一年,Impella心脏泵已经历四次最严重的I级召回。这表明了该设备可能存在的严重风险,甚至可能威胁到患者的生命安全。在2023年4月,由于泄漏清洗液的问题,带有SmartAssist功能的Impella 5.5心脏泵进行了部分召回。而在2023年6月,Abiomed对Impella RP Flex心脏泵进行了召回,原因是凝血高于预期。同月,Abiomed还警告称Impella心脏泵可能与经导管主动脉瓣置换(TAVR)支架存在相互作用问题,导致四起死亡案例。
FDA在随后的检查中发现,Abiomed在收到Impella 5.5心脏泵投诉率“高得令人无法接受”后,仍然推迟发布召回通知,对此发出了警告信。警告信中还提到,该公司使用了未经FDA授权的软件。随后,2023年7月,Abiomed对Impella心脏泵发起了一次I级召回,原因是这些设备可能与TAVR瓣膜支架相互干扰,导致器械损伤。尽管召回级别严重,但Abiomed并没有实际回收产品,而是通过发布召回通知提醒医疗人员注意潜在风险,并强调产品无需回收或替换。
而在2024年,Abiomed近期发起了其历史上规模最大的召回行动,全球回收了6个型号的Impella心脏泵。主要措施包括更换使用说明书,并新增了关于心室穿孔风险的5条警告。
值得一提的是,强生公司已经对此做出了回应,并表示已经更新了Impella系统的使用说明,以进一步解决心室穿孔这一罕见并发症的潜在风险。

近期,强生公司就备受关注的Impella心脏泵召回事件发布了声明,澄清召回并不意味着产品下架。据了解,Impella人工心脏仍可供患者使用,并且该公司已更新了Impella系统的使用说明,以进一步减少左心室穿孔等罕见并发症的风险。
Impella是目前唯一一款获得美国FDA批准上市的产品,也是介入式人工心脏最早商业化的产品之一。截至2023年11月,全球已有超过30万患者接受了Impella系列产品治疗。
Abiomed作为Impella的生产商,曾凭借这一产品实现了股价的飙升。据报道,从2009年3月至2018年6月,Abiomed股价涨幅超过了79倍,成为标普500指数成分股中的“最强牛股”。2022年财年,Abiomed的营收超过10亿美元,其中Impella贡献超过95%的营收,达到了9.85亿美元。
值得一提的是,2022年11月,强生公司以166亿美元的价格收购了Abiomed,旨在促进其医疗设备部门的增长。这次收购被视为强生自宣布剥离消费健康业务后的首笔重大交易,也创下了其历史上的收购规模之最。然而,收购完成后不久,Abiomed却因Impella心脏泵的召回事件而陷入风波。
有关此事,生命盾医疗联合创始人兼董事长Tim Kaufmann表示,Impella召回并非医疗器械行业的首个案例,但它进一步彰显了作为医疗设备开发商的责任。他认为,召回事件不会阻碍人工心脏领域的研发创新进程,相反,这个领域需要更多的竞争,同时也需要所有人以最谨慎的态度工作,解决可能出现的任何问题。
另一位医疗器械领域资深人士表示,美国FDA一直在鼓励创新医疗器械的上市,但在产品上市后会进行严格的不良事件监测,一旦发现问题会及时召回并纠正。





















































































































































































网友评论
最新评论